半導体のエネルギー帯って案外キッチリ理解できている人は少ないのでは無いでしょうか。
私は一年前に習ったのにも関わらず、これが分子軌道がからんでくるということを知りませんでした。
そこで私が調べた半導体のエネルギー帯にの構造について、調べました。
「なにが帯やねん!」というツッコミに対しても完璧に答えられるようにしたつもりですので、是非最後まで読んで行ってください。
学部生の理解の助けにもなるはずです。
原子軌道と分子軌道
まずこのエネルギー帯を理解するためには、まず原子軌道とそれの結合した分子軌道について考えなければなりません。
一番簡単な水素原子に関するモデルを考えます。
水素原子は電子は1個で、1s軌道にのみ入っています。
![]()
このようにして原子軌道同士が軌道を共有する事で、分子軌道ができて、結合性軌道と言うもとの原子軌道よりも安定なエネルギー準位を持つ軌道が生まれます。
世の中はエネルギー準位が低い方が安定しますから、結合してエネルギーが下がる結合性軌道に入れる事はうれしい事なのです。だから水素は原子より分子になった方が結合性軌道にエネルギー準位が落ちるのでうれしいのです。
一方、ヘリウムのような単原子分子は、分子軌道は次のようになります。
のようになります。
このようになると、ヘリウムは反結合性軌道σ*に電子をいれなくてはなりません。なぜなら結合性軌道だけでは、電子4個を埋めるには足りないからです。しかし、よく見てください。元のエネルギー準位と結合性軌道の差より、反結合性軌道と元のエネルギー準位の差の方が大きいのです。
そして、この差が大きい方の軌道に電子を入れなければならないため、元々よりもエネルギーが高くなり、不安定になるのです。だからヘリウムのような希ガスはそのままの原子の方が安定なのです。
また、この図
で結合性軌道(下)は白丸二つなのに対して上は白丸と黒丸になっています。これは黒丸の位相が逆であると言う事を表します。
なので、この軌道の断面を見るとこのようになります。
このようになります。反結合性軌道をご覧下さい。真ん中で軌道が無くなっていますよね。だから結合していないと言う事になります。同じ居そうなら左のようにキッチリ結合して軌道が繋がっている事が分かります。
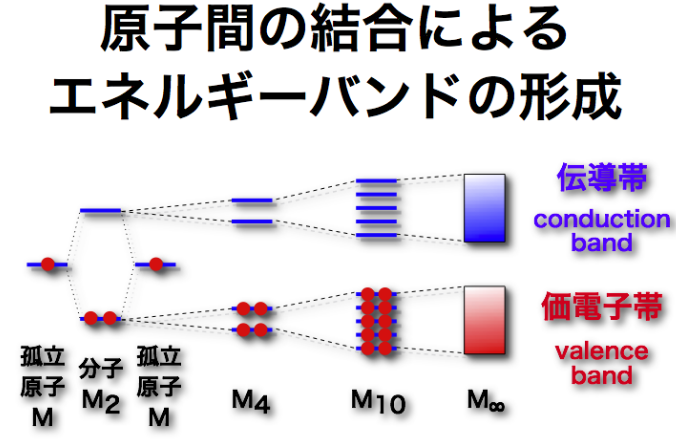
結合する原子の数と分子軌道の数の関係性
半導体などのエネルギー帯を考える上で、この結合原子数と分子軌道の数の議論がメチャクチャ大事になってきます。
もしH原子が3個だったら、分子軌道は何個になるかと言うと、これは3個になるのです。先ほど、2個のときに2個の分子軌道になりました。
3個のときは3個の分子軌道になります。
このように考えると、
N個の原子があれば、N個の分子軌道が出来ます。
上の図のようにまず左から、1個ずつの原子の結合であれば、分子軌道が結合性軌道と反結合性軌道の2つになります。また、4個になれば結合性軌道のが2つ、反結合性軌道が2つの4本の分子軌道になります。
このように原子軌道が10本なら、結合性軌道が5本、反結合性軌道が5本の合計10本の分子軌道が出来ます。
じゃあ結晶のように数えきれないくらい原子軌道が結合すれば、密集しすぎて『帯』のようになります。これをエネルギー帯と言い、エネルギーバンドとも言います。
シリコンの場合のエネルギーバンド
シリコンのポテンシャルエネルギーを考えます。
このようになります。
Siの電子配置は、(1s)2(2s)2(2p)6(3s)2(3p)2と言う風になります。
Siは共有結合結晶と言うことで、分子軌道を作りますが、無数のSiと結合します。それをポテンシャルと軌道をあわせた図を用意しましたので下をご覧下さい。
![]()
深いエネルギー準位にある軌道はポテンシャルの壁がある事によって、隣接原子の影響を受けないので、『内角軌道』と言われています。また、3s,3pのように図のポテンシャルの壁を元々超えている軌道は隣の原子の影響を受けます。この軌道にある電子の事を『価電子』と言います。
3s,3pは隣接原子と結合する時に使われるので、原子軌道から分子軌道が作られます。すると、エネルギー準位が分裂して結合性軌道と反結合性軌道が出来ます。
そして、結合性軌道が密集して、価電子帯、反結合性軌道が密集して伝導体が出来ます。
価電子帯や伝導帯などのように、分子軌道が重なっている物をエネルギー帯と言います。
このようにして、原子軌道が重なり、分子軌道になり、結合性軌道と反結合性軌道のようにエネルギー準位が分裂して、それが重なる事でエネルギー帯が出来るのです。
このようにしてエネルギー帯ができるのです。